


近日,河北森朗生物科技有限公司在高新區舉辦了“細胞治療產品商業化生產基地項目”開工儀式。石家莊高新區黨工委副書記楊文斌、石家莊市國際生物醫藥園管委會黨組書記秦吉輝出席活動,生物醫藥園、朗脈科技相關人員參加。該項目位于石家莊國際生物醫藥園內,總建筑面積1.4萬平方米,總投資1.2億元,主要建設質粒車間、慢病

9月23日,河北森朗生物科技有限公司與河北燕達陸道培醫院陸佩華教授團隊合作在血液科國際權威期刊American Journal of Hematology(IF=12.8)發表了題為“Analysis of 60 patients with relapsed or refractory T-cell acute lymphoblastic leukemia and T-cell lymphoblastic lymphoma treated with CD7-targeted chimeric
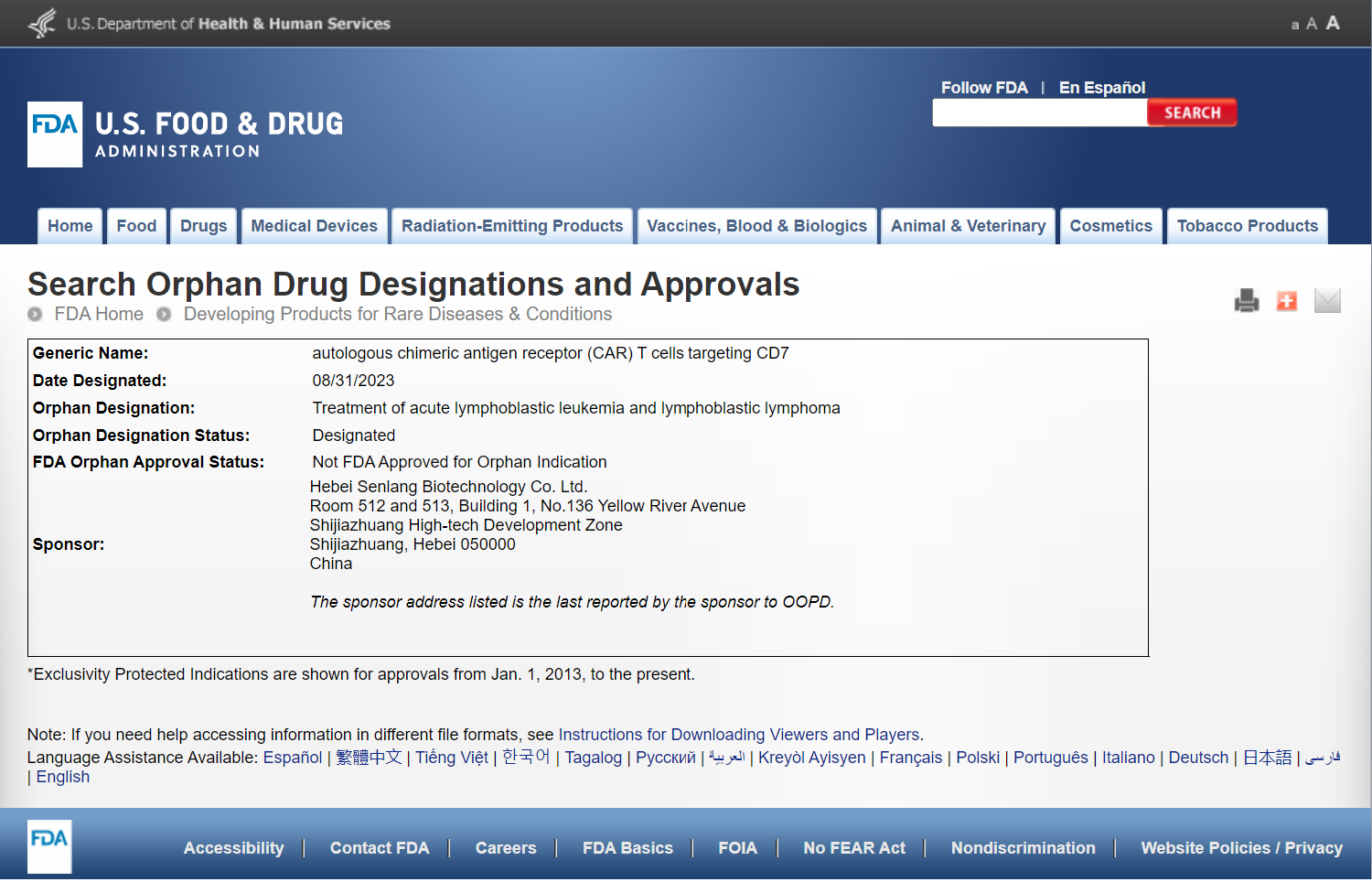
近日,河北森朗生物科技有限公司(以下簡稱森朗生物)收到美國食品藥品監督管理局(FDA)孤兒藥開發辦公室(OOPD)正式書面回函,其自主研發的靶向CD7的CAR-T細胞產品(SENL101自體T細胞注射液)被授予孤兒藥資格認定(ODD),用于治療成人復發或難治性T淋巴母細胞淋巴瘤/白血病(T-LBL/ALL)。本次孤兒藥資格認定主要基于S

一、概述(一)前言近年來,隨著細胞和基因治療相關科學理論、技術手段、臨床醫療實踐的不斷進展,以及監管政策的逐漸完善,細胞和基因治療產品的臨床研發獲得蓬勃快速發展。目前,在全球范圍內已有多款、多種類型的細胞和基因治療產品獲批上市,國內也有治療惡性血液腫瘤的 CAR-T 產品上市,多款治療不同適應癥的細胞和基因
2023年6月19日,據國家藥品監督管理局藥品審評中心(CDE)官網顯示,河北森朗生物科技有限公司(以下簡稱“森朗生物”)自主研發的靶向CD7 CAR-T產品“SENL101自體T細胞注射液”獲得臨床試驗默示許可,適應癥為:成人復發或難治性T淋巴母細胞淋巴瘤/白血病(T-LBL/ALL)(受理號:CXSL2300225)。此次獲批IND的“SENL101自體

VaxcellBio CEO 李濟中教授(左)與森朗生物CEO郭勝敏女士(右)2023年4月12日,河北森朗生物科技有限公司與韓國VaxcellBio簽署產品授權合作協議,將森朗生物自主研發的納米抗體BCMA-CART產品授權給VaxcellBio,由VaxcellBio主導在韓國進行產品的注冊申報、臨床試驗和上市銷售;同時雙方將依托各自優勢共同合作開發針對多發性

重磅!森朗生物Senl_B19自體T細胞注射液產品I期臨床研究在北京大學人民醫院正式啟動2022年8月1日,河北森朗生物科技有限公司(以下簡稱“森朗生物”)申辦的Senl_B19自體T細胞注射液產品針對復發難治性CD19陽性B細胞急性淋巴細胞白血病的I期臨床研究由項目PI北京大學人民醫院黃曉軍教授領銜,血液科和兒科多位專家共同參與,

Blood特邀專家對森朗生物研發的無需基因編輯的自然選擇CD7 CAR-T研究成果進行點評7月28日,森朗生物研發生產的無需基因編輯的自然選擇CD7 CAR-T(NS7CAR)研究論文Naturally Selected CD7 CAR -T Therapy without Genetic Manipulations for T-ALL/LBL: First-in-human Phase I Clinical Trial繼被國際血液學權威期刊

自2017年底2種CAR-T細胞療法獲得FDA批準之后,此后直到今年7月初,依舊沒有其他的CAR-T細胞療法獲得批準上市。而自CAR-T細胞療法獲批以來,全世界開始迅速掀起CAR-T細胞療法研究熱潮,治療的癌癥范圍也在不斷地擴大,而就在7月24日(美國時間),FDA再次批準了一項新的CAR-T細胞療法上市!和之前已經獲得批準的2款CAR-T細胞

細胞療法具有改善人類健康的巨大潛力。然而,如果不進行嚴謹的科學和臨床研究,以支持這些產品的安全性和有效性,那么這類產品的潛力將永遠不會實現。7月6日,國家藥品監督管理局藥品審評中心正式對外發布《免疫細胞治療產品臨床試驗技術指導原則(征求意見稿)》(下簡稱《原則》),向社會公開征求意見,時限為自發布之日起一